移动|高中化学:“四大平衡”考点总结!可下载电子版
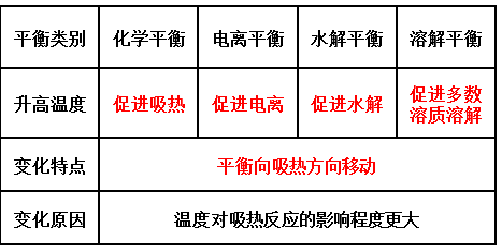
高中化学教材中 , 有一个平衡理论体系 , 包括 溶解平衡、化学平衡、电离平衡、水解平衡、络合平衡等 。
化学平衡是这一平衡理论体系的核心 。 系统掌握反应速率与化学平衡的概念、理论及应用对于深入认识其他平衡 , 重要的酸、碱、盐的性质和用途 , 化工生产中适宜条件的选择等 , 具有承上启下的作用;
对于深入掌握元素化合物的知识 , 具有理论指导意义 。 正因为它的重要性 , 所以 , 在历年高考中 , 这一部分向来是考试的热点、难点 。
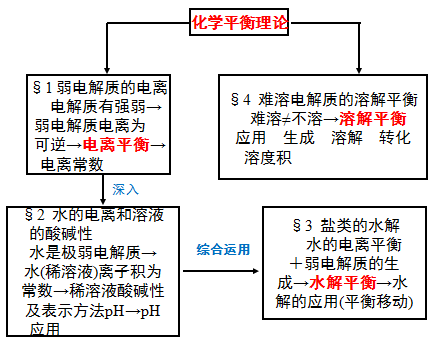
1.高中化学常见四大平衡
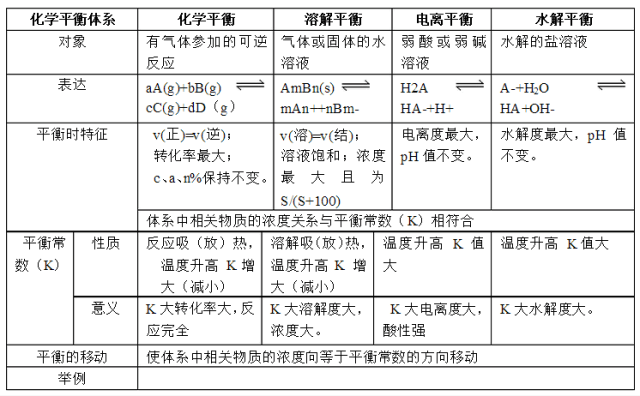
文章图片
2.常见四大平衡研究对象
模型一、化学平衡
研究对象:可逆反应 。 如:
加热不利于氨的生成 , 增大压强有利于氨的生成 。
模型二、电离平衡:
研究对象:弱电解质 。 如: 加热促进电离 , 稀释电离度增大 。
模型三、水解平衡
研究对象:弱酸盐或弱碱盐或弱酸弱碱盐 。 如: 配制 溶液应加入少量酸防止 水解 。 不断加热 溶液 , 蒸干灼烧可得到 固体 。
模型四、溶解平衡
研究对象:气体或固体溶于水形成的饱和溶液中形成的平衡体系 。
(1)气体的溶解平衡
如: 当加入
等时平衡会发生移动 。 当收集 等气体时往往分别通过饱和的 等溶液以除去可能有的酸性气体 , 且抑制气体的溶解 。
(2)固体的溶解平衡如:
如: 加热促进溶解; 加热溶解度降低;反应的进行是由于存在溶解平衡;;由于能水解 , 加热时的水解程度增大 , 促进了的溶解 , 最终转化成 。
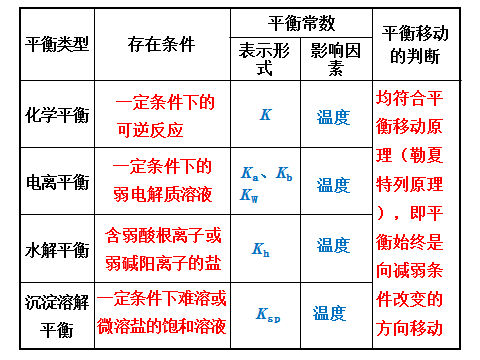
知识结构
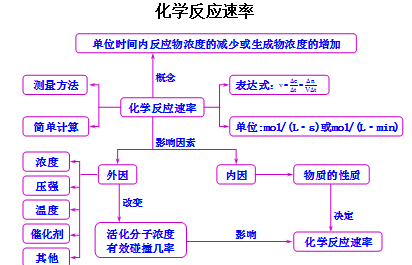
文章图片
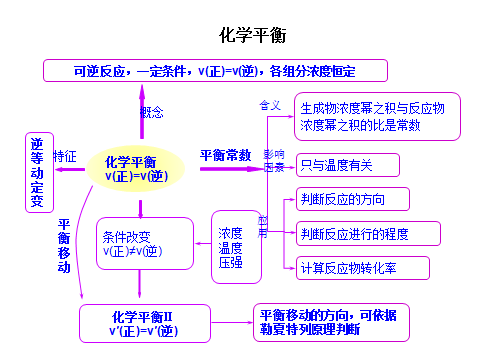
文章图片
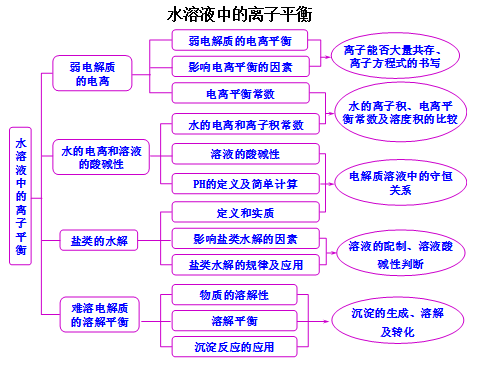
文章图片
归纳总结
四大平衡无论是理论学习还是解题方法 , 都有许多的共通之处 。 归纳总结四大平衡的共同点是一种有效的复习方法 。
文章图片
文章图片
1. 所有的平衡都建立在“可逆反应”的基础上
2.平衡特征相同
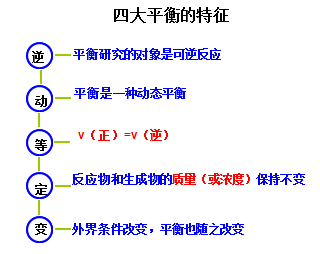
文章图片
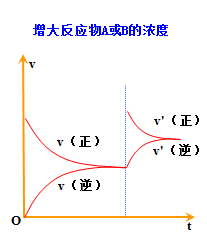
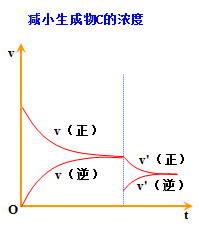
3.都可借助v-t图学习平衡的建立及平衡的移动
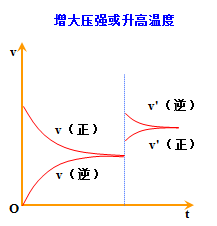
文章图片
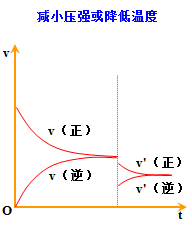
文章图片
文章图片
文章图片
4. 都能用勒夏特列原理解释平衡的移动
勒夏特列原理:如果改变影响平衡的一个条件(如温度、浓度、压强等) , 平衡就向减弱这个改变的方向移动.
平衡的实质是两个变化方向的速率相等 , 所以影响平衡的因素首先是影响速率的因素:
(1)温度:升温促进吸热过程进行
文章图片
(2)浓度:增大某物质浓度 , 平衡向消耗该物质的方向移动
推荐阅读
- 教育部|终于轮到高中生“减负”了,教学进度将大幅调整,教育部已有通知
- 考试|高中生自创“汤圆”字体,风格可爱似元宝,老师看了忍不住夸赞!
- 教师|教育部通知:禁止高中提前“结课”,同时教师也迎来“好消息”
- 高中物理|高中物理:电场、磁场解题宝典,建议收藏!
- 高中|高中九大学科思维导图最全汇总,高中三年都适用!(收藏)
- 疫情|疫情下,6个日夜,中山3名高中生“隔离”学习考试
- 高中生|韩调查:韩国中学生最想当老师
- 成人高考|没有高中毕业证可以报名成人高考吗?
- 职业教育|学霸都在偷偷用!高中语文:诗歌鉴赏答题技巧,吃透不丢分!
- 高中物理|评上副高之后,优秀名额都让给别人了,教师:我也10多年不优秀了














