今天 , 林紫给大家送上高中化学常考知识点大汇总 , 学霸必备复习手册 , 可下载电子版 , 下载方法见文尾 。
01
高中化学必修一
1、混合物的分离
①过滤:固体(不溶)和液体的分离 。
②蒸发:固体(可溶)和液体分离 。
③蒸馏:沸点不同的液体混合物的分离 。
④分液:互不相溶的液体混合物 。
⑤萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同 , 用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来 。
2、粗盐的提纯
(1)粗盐的成分:主要是NaCl , 还含有MgCl2、CaCl2、Na2SO4、泥沙等杂质
(2)步骤:
①将粗盐溶解后过滤;
②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、Na2CO3(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;
③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;
④蒸发、结晶得到精盐 。
【 加试剂顺序关键: Na2CO3在BaCl2之后; 盐酸放最后 。 】
(3)蒸馏装置注意事项:
①加热烧瓶要垫上石棉网;
②温度计的水银球应位于蒸馏烧瓶的支管口处;
③加碎瓷片的目的是防止暴沸;
④冷凝水由下口进 , 上口出 。
(4)从碘水中提取碘的实验时 , 选用萃取剂应符合原则:
①被萃取的物质在萃取剂溶解度比在原溶剂中的大得多;
②萃取剂与原溶液溶剂互不相溶;
③萃取剂不能与被萃取的物质反应 。
3、离子的检验:
①SO42-:先加稀盐酸 , 再加BaCl2溶液有白色沉淀 , 原溶液中一定含有SO42- 。 Ba2++SO42-=BaSO4↓
②Cl-(用AgNO3溶液、稀硝酸检验)加AgNO3溶液有白色沉淀生成 , 再加稀硝酸沉淀不溶解 , 原溶液中一定含有Cl-;或先加稀硝酸酸化 , 再加AgNO3溶液 , 如有白色沉淀生成 , 则原溶液中一定含有Cl- 。 Ag++Cl-=AgCl↓ 。
③CO32-:(用BaCl2溶液、稀盐酸检验)先加BaCl2溶液生成白色沉淀 , 再加稀盐酸 , 沉淀溶解 , 并生成无色无味、能使澄清石灰水变浑浊的气体 , 则原溶液中一定含有CO32- 。
4、5个新的化学符号及关系
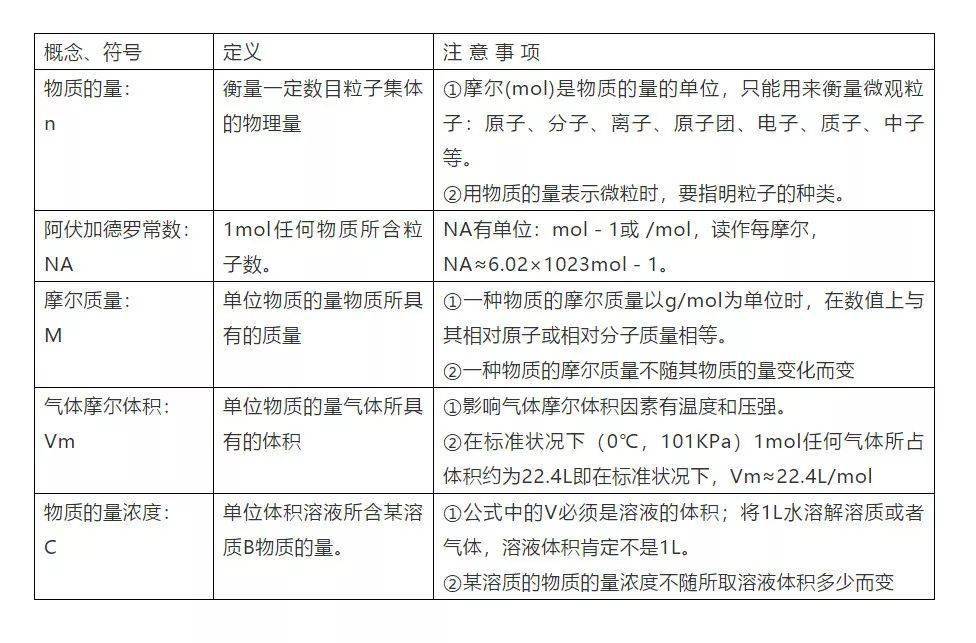
文章图片
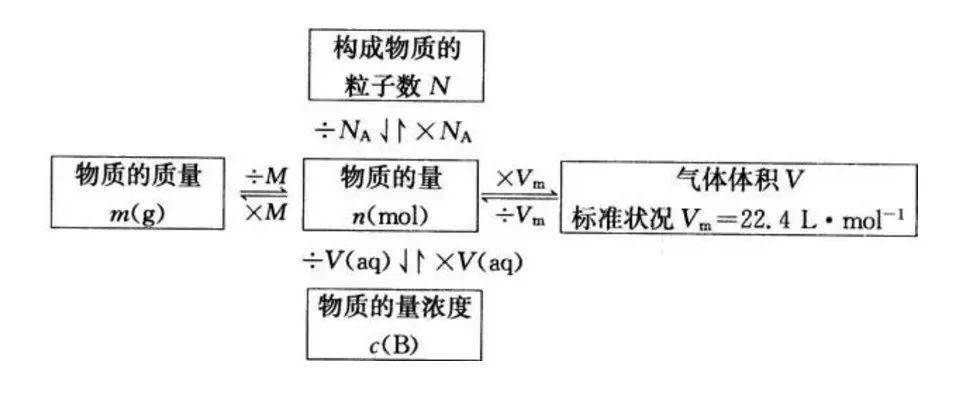
文章图片
5、分散系
①分散系组成:分散剂和分散质 , 按照分散质和分散剂所处的状态 , 分散系可以有9种组合方式 。
②当分散剂为液体时 , 根据分散质粒子大小可以将分散系分为溶液、胶体、浊液 。
6、胶体:
①常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等 。
②胶体的特性:能产生丁达尔效应 。 区别胶体与其他分散系常用方法丁达尔效应 。
胶体与其他分散系的本质区别是分散质粒子大小 。
③Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中 , 继续加热至体系呈红褐色 , 停止加热 , 得Fe(OH)3胶体 。
7、电解质和非电解质
①电解质:在水溶液里或熔融状态下能导电的化合物 。
②非电解质:在水溶液中和熔融状态下都不能导电的化合物 。 (如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质 。 )
8、电解质和非电解质相关性质
①电解质和非电解质都是化合物 , 单质和混合物既不是电解质也不是非电解质 。
②酸、碱、盐和水都是电解质(特殊:盐酸(混合物)电解质溶液) 。
推荐阅读
- 教育部|终于轮到高中生“减负”了,教学进度将大幅调整,教育部已有通知
- 考试|高中生自创“汤圆”字体,风格可爱似元宝,老师看了忍不住夸赞!
- 教师|教育部通知:禁止高中提前“结课”,同时教师也迎来“好消息”
- 高中物理|高中物理:电场、磁场解题宝典,建议收藏!
- 高中|高中九大学科思维导图最全汇总,高中三年都适用!(收藏)
- 疫情|疫情下,6个日夜,中山3名高中生“隔离”学习考试
- 高中生|韩调查:韩国中学生最想当老师
- 成人高考|没有高中毕业证可以报名成人高考吗?
- 职业教育|学霸都在偷偷用!高中语文:诗歌鉴赏答题技巧,吃透不丢分!
- 高中物理|评上副高之后,优秀名额都让给别人了,教师:我也10多年不优秀了










