Al2O3是两性氧化物:既能与强酸反应 , 又能与强碱反应:
Al2O3+ 6HCl =2AlCl3 + 3H2O (Al2O3+6H+=2Al3++3H2O )
Al2O3+ 2NaOH == 2NaAlO2 +H2O(Al2O3+2OH-=2AlO2-+H2O)
(2)铁的氧化物的性质:
FeO、Fe2O3都为碱性氧化物 , 能与强酸反应生成盐和水 。
FeO+2HCl =FeCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O
27、氢氧化物
(1)氢氧化铝 Al(OH)3
①Al(OH)3是两性氢氧化物 , 在常温下它既能与强酸 , 又能与强碱反应:
Al(OH)3+3HCl=AlCl3+3H2O(Al(OH)3+3H+=Al3++3H2O)
Al(OH)3+NaOH=NaAlO2+2H2O(Al(OH)3+OH-=AlO2-+2H2O)
②Al(OH)3受热易分解成Al2O3:2Al(OH)3==Al2O3+3H2O(规律:不溶性碱受热均会分解)
③Al(OH)3的制备:实验室用可溶性铝盐和氨水反应来制备Al(OH)3
Al2(SO4)3+6NH3·H2O=2 Al(OH)3↓+3(NH4)2SO4
(Al3++3NH3·H2O=Al(OH)3↓+3NH4+)
因为强碱(如NaOH)易与Al(OH)3反应 , 所以实验室不用强碱制备Al(OH)3 , 而用氨水 。
(2)铁的氢氧化物:
氢氧化亚铁Fe(OH)2(白色)和氢氧化铁Fe(OH)3(红褐色)
①都能与酸反应生成盐和水:
Fe(OH)2+2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)
Fe(OH)3+3HCl=FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)
②Fe(OH)2可以被空气中的氧气氧化成Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3(现象:白色沉淀→灰绿色→红褐色)
③Fe(OH)3受热易分解生成Fe2O3:2Fe(OH)3==Fe2O3+3H2O
(3)氢氧化钠NaOH:
俗称烧碱、火碱、苛性钠 , 易潮解 , 有强腐蚀性 , 具有碱的通性 。
28、盐
(1)铁盐(铁为+3价)、亚铁盐(铁为+2价)的性质:
①铁盐(铁为+3价)具有氧化性 , 可以被还原剂(如铁、铜等)还原成亚铁盐:
2FeCl3+Fe=3FeCl2( 2Fe3++Fe=3Fe2+ )(价态归中规律)
2FeCl3+Cu=2FeCl2+CuCl2( 2Fe3++Cu=2Fe2++Cu2+)(制印刷电路板的反应原理)
②亚铁盐(铁为+2价)具有还原性 , 能被氧化剂(如氯气、氧气、硝酸等)氧化成铁盐:2FeCl2+Cl2=2FeCl3 ( 2Fe2++Cl2=2Fe3++2Cl- )
③Fe3+离子的检验:
a.溶液呈黄色;
b.加入KSCN(硫氰化钾)溶液变红色;
c.加入NaOH溶液反应生成红褐色沉淀[Fe(OH)3] 。
④Fe2+离子的检验:
a.溶液呈浅绿色;
b.先在溶液中加入KSCN溶液 , 不变色 , 再加入氯水 , 溶液变红色;
c.加入NaOH溶液反应先生成白色沉淀 , 迅速变成灰绿色沉淀 , 最后变成红褐色沉淀 。
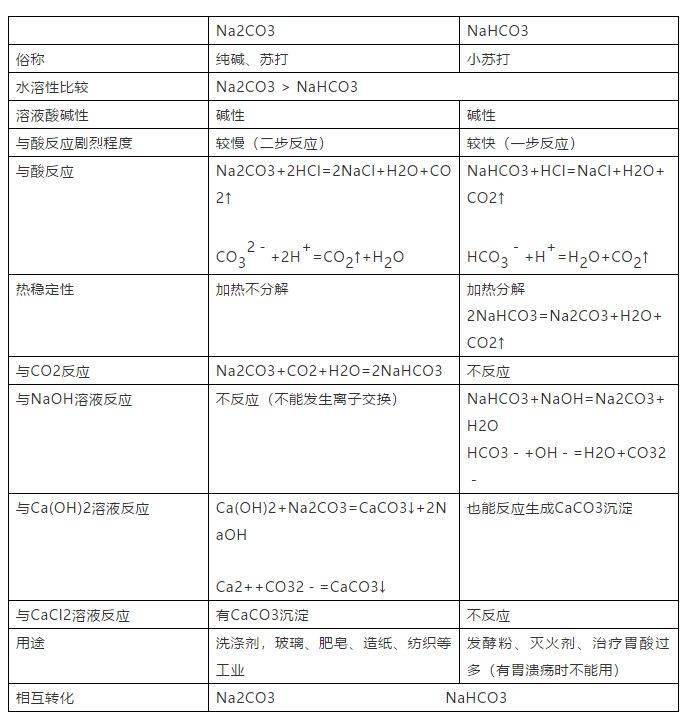
(2)钠盐:Na2CO3与NaHCO3的性质比较
文章图片
29、焰色反应
①定义:金属或它们的化合物在灼烧时使火焰呈现特殊颜色的性质 。
②操作步骤:铂丝(或铁丝)用盐酸浸洗后灼烧至无色 , 沾取试样(单质、化合物、气、液、固均可)在火焰上灼烧 , 观察颜色 。
③重要元素的焰色:钠元素黄色、 钾元素紫色(透过蓝色的钴玻璃观察 , 以排除钠的焰色的干扰)
焰色反应属物理变化 。 与元素存在状态(单质、化合物)、物质的聚集状态(气、液、固)等无关 , 只有少数金属元素有焰色反应 。
30、硅及其化合物 Si
①硅元素在地壳中的含量排第二 , 在自然界中没有游离态的硅 , 只有以化合态存在的硅 , 常见的是二氧化硅、硅酸盐等 。
②硅的原子结构示意图为 , 硅元素位于元素周期表第三周期第ⅣA族 , 硅原子最外层有4个电子 , 既不易失去电子又不易得到电子 , 主要形成四价的化合物 。
推荐阅读
- 教育部|终于轮到高中生“减负”了,教学进度将大幅调整,教育部已有通知
- 考试|高中生自创“汤圆”字体,风格可爱似元宝,老师看了忍不住夸赞!
- 教师|教育部通知:禁止高中提前“结课”,同时教师也迎来“好消息”
- 高中物理|高中物理:电场、磁场解题宝典,建议收藏!
- 高中|高中九大学科思维导图最全汇总,高中三年都适用!(收藏)
- 疫情|疫情下,6个日夜,中山3名高中生“隔离”学习考试
- 高中生|韩调查:韩国中学生最想当老师
- 成人高考|没有高中毕业证可以报名成人高考吗?
- 职业教育|学霸都在偷偷用!高中语文:诗歌鉴赏答题技巧,吃透不丢分!
- 高中物理|评上副高之后,优秀名额都让给别人了,教师:我也10多年不优秀了












