31、单质硅(Si):
(1)物理性质:有金属光泽的灰黑色固体 , 熔点高 , 硬度大 。
(2)化学性质:
①常温下化学性质不活泼 , 只能跟F2、HF和NaOH溶液反应 。
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
②在高温条件下 , 单质硅能与O2和Cl2等非金属单质反应 。
(3)用途:太阳能电池、计算机芯片以及半导体材料等 。
(4)硅的制备:工业上 , 用C在高温下还原SiO2可制得粗硅 。
SiO2+2C=Si(粗)+2CO↑
Si(粗)+2Cl2=SiCl4
SiCl4+2H2=Si(纯)+4HCl
32、二氧化硅(SiO2):
(1)SiO2的空间结构:立体网状结构 , SiO2直接由原子构成 , 不存在单个SiO2分子 。
(2)物理性质:熔点高 , 硬度大 , 不溶于水 。
(3)化学性质:SiO2常温下化学性质很不活泼 , 不与水、酸反应(氢氟酸除外) , 能与强碱溶液、氢氟酸反应 , 高温条件下可以与碱性氧化物反应:
①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性 , 所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液 , 避免Na2SiO3将瓶塞和试剂瓶粘住 , 打不开 , 应用橡皮塞) 。
②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应 , 氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放 , 应用塑料瓶) 。
③高温下与碱性氧化物反应:SiO2+CaOCaSiO3
(4)用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等 。
33、硅酸(H2SiO3):
①物理性质:不溶于水的白色胶状物 , 能形成硅胶 , 吸附水分能力强 。
②化学性质:H2SiO3是一种弱酸 , 酸性比碳酸还要弱 , 其酸酐为SiO2 , 但SiO2不溶于水 , 故不能直接由SiO2溶于水制得 , 而用可溶性硅酸盐与酸反应制取:(强酸制弱酸原理)
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(此方程式证明酸性:H2SiO3<H2CO3)
③用途:硅胶作干燥剂、催化剂的载体 。
34、硅酸盐
硅酸盐:硅酸盐是由硅、氧、金属元素组成的化合物的总称 。 硅酸盐种类很多 , 大多数难溶于水 , 最常见的可溶性硅酸盐是Na2SiO3 , Na2SiO3的水溶液俗称水玻璃 , 又称泡花碱 , 是一种无色粘稠的液体 , 可以作黏胶剂和木材防火剂 。 硅酸钠水溶液久置在空气中容易变质:
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓(有白色沉淀生成)
传统硅酸盐工业三大产品有:玻璃、陶瓷、水泥 。
硅酸盐由于组成比较复杂 , 常用氧化物的形式表示:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水 。 氧化物前系数配置原则:除氧元素外 , 其他元素按配置前后原子个数守恒原则配置系数 。
硅酸钠:Na2SiO3 Na2O·SiO2
硅酸钙:CaSiO3 CaO·SiO2
高岭石:Al2(Si2O5)(OH)4 Al2O3·2SiO2·2H2O
正长石:KAlSiO3不能写成K2O· Al2O3·3SiO2 , 应写成K2O·Al2O3·6SiO2
35、氯及其化合物
①氯原子结构示意图为:
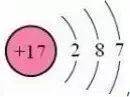
文章图片
氯元素位于元素周期表中第三周期第ⅦA族 , 氯原子最外电子层上有7个电子 , 在化学反应中很容易得到1个电子形成
②Cl- , 化学性质活泼 , 在自然界中没游离态的氯 , 氯只以化合态存在(主要以氯化物和氯酸盐) 。
36、氯气(Cl2):
(1)物理性质:黄绿色有刺激性气味有毒的气体 , 密度比空气大 , 易液化成液氯 , 易溶于水 。 (氯气收集方法—向上排空气法或者排饱和食盐水;液氯为纯净物)
推荐阅读
- 教育部|终于轮到高中生“减负”了,教学进度将大幅调整,教育部已有通知
- 考试|高中生自创“汤圆”字体,风格可爱似元宝,老师看了忍不住夸赞!
- 教师|教育部通知:禁止高中提前“结课”,同时教师也迎来“好消息”
- 高中物理|高中物理:电场、磁场解题宝典,建议收藏!
- 高中|高中九大学科思维导图最全汇总,高中三年都适用!(收藏)
- 疫情|疫情下,6个日夜,中山3名高中生“隔离”学习考试
- 高中生|韩调查:韩国中学生最想当老师
- 成人高考|没有高中毕业证可以报名成人高考吗?
- 职业教育|学霸都在偷偷用!高中语文:诗歌鉴赏答题技巧,吃透不丢分!
- 高中物理|评上副高之后,优秀名额都让给别人了,教师:我也10多年不优秀了










