(4)氨气的用途:液氨易挥发 , 汽化过程中会吸收热量 , 使得周围环境温度降低 , 因此 , 液氨可以作制冷剂 。
45、铵盐
铵盐均易溶于水 , 且都为白色晶体(很多化肥都是铵盐) 。
①受热易分解 , 放出氨气:
②干燥的铵盐能与碱固体混合加热反应生成氨气 , 利用这个性质可以制备氨气:
③NH4+的检验:样品加碱混合加热 , 放出的气体能使湿的红色石蕊试纸变蓝 , 则证明该物质会有NH4+ 。
02
高中化学必修二
46、原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个) , 次外层不超过18个 , 倒数第三层电子数不超过32个 。
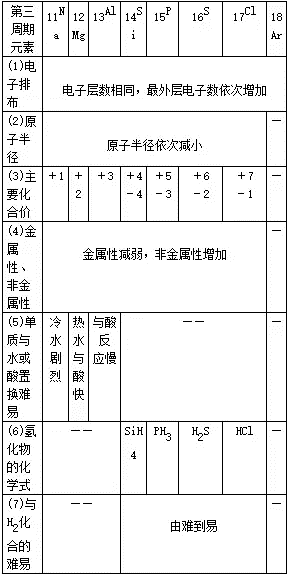
47、同周期元素性质递变规律
文章图片
第ⅠA族碱金属元素:Li Na KRb Cs Fr(Fr是金属性最强的元素 , 位于周期表左下方)
第ⅦA族卤族元素:F Cl Br IAt(F是非金属性最强的元素 , 位于周期表右上方)
48、判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu 。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2 。
同周期比较:

文章图片
49、比较粒子(包括原子、离子)半径的方法:
①先比较电子层数 , 电子层数多的半径大 。
②电子层数相同时 , 再比较核电荷数 , 核电荷数多的半径反而小 。
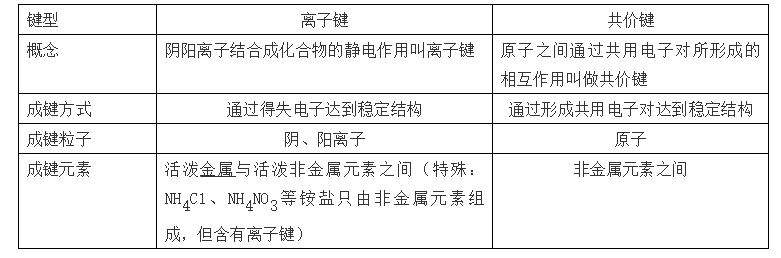
50、离子键与共价键的比较
文章图片
离子化合物:由离子键构成的化合物叫做离子化合物 。 (一定有离子键 , 可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物 。 (只有共价键)
51、电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:
①电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷 。
②[ ](方括号):离子键形成的物质中的阴离子需用方括号括起来 , 而共价键形成的物质中不能用方括号 。
52、常见的放热反应
①所有的燃烧与缓慢氧化 。
②酸碱中和反应 。
③金属与酸反应制取氢气 。
④大多数化合反应(特殊:是吸热反应) 。
53、常见的吸热反应:
① 以C、H2、CO为还原剂的氧化还原反应如:
②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等 。
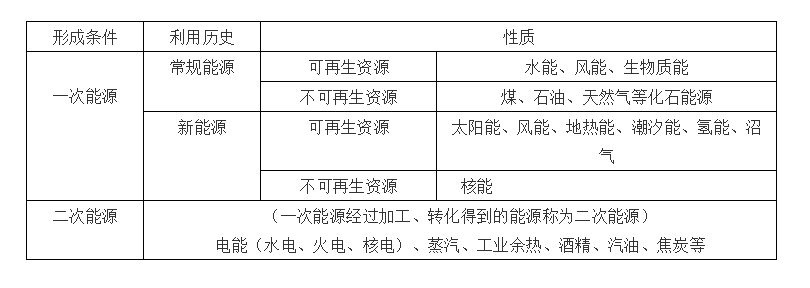
54、能源的分类:
文章图片
【思考】一般说来 , 大多数化合反应是放热反应 , 大多数分解反应是吸热反应 , 放热反应都不需要加热 , 吸热反应都需要加热 , 这种说法对吗?试举例说明 。
点拔:这种说法不对 。 如C+O2=CO2的反应是放热反应 , 但需要加热 , 只是反应开始后不再需要加热 , 反应放出的热量可以使反应继续下去 。 Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 , 但反应并不需要加热 。
推荐阅读
- 教育部|终于轮到高中生“减负”了,教学进度将大幅调整,教育部已有通知
- 考试|高中生自创“汤圆”字体,风格可爱似元宝,老师看了忍不住夸赞!
- 教师|教育部通知:禁止高中提前“结课”,同时教师也迎来“好消息”
- 高中物理|高中物理:电场、磁场解题宝典,建议收藏!
- 高中|高中九大学科思维导图最全汇总,高中三年都适用!(收藏)
- 疫情|疫情下,6个日夜,中山3名高中生“隔离”学习考试
- 高中生|韩调查:韩国中学生最想当老师
- 成人高考|没有高中毕业证可以报名成人高考吗?
- 职业教育|学霸都在偷偷用!高中语文:诗歌鉴赏答题技巧,吃透不丢分!
- 高中物理|评上副高之后,优秀名额都让给别人了,教师:我也10多年不优秀了











